国内では、新型コロナウイルス(2019-nCoV/SARS-CoV-2)への感染例が連日報告されている。感染経路をたどれない感染例が増え、流行期のフェーズに移ってきた。しかし政府によれば、国内での新型コロナウイルスの遺伝子検査のキャパシティーは、2月12日時点で1日最大300件止まり。2月18日から1日3800件に増強されたとは言うものの、実際に検査された件数は、1日当たり約600件から約1500件程度にとどまっている。「検査を断られた」という医療機関も出てきている。大規模流行の可能性が目前に迫っているのになんとも心もとない状況だ。なぜ、新型コロナウイルスの検査体制の増強がここまで後手後手になっているのか、本誌(日経バイオテク)の記者が時系列で検証する。
新型コロナウイルスの遺伝子検査(PCR法)とは?
毎年流行するインフルエンザのように、既存の感染症の診断には、病院や診療所で患者から咽頭拭い液(口を大きく開け、綿棒の先でへんとう腺などをこすって採取した検査材料)などを採取して、その場ですぐに結果が分かる迅速診断キットなどが使われている。迅速診断キットは、ウイルス抗原を特異的に認識する抗体を使って、イムノクロマト法などで咽頭拭い液などに含まれるウイルス抗原を検出するものだ。国内ではインフルエンザだけでも30種類以上の迅速診断キットが実用化しているが、それらはいずれも厚生労働省から体外診断薬の承認を得て販売されている。
しかし、今回の新型コロナウイルスによる感染症(COVID-19)のように、新しい感染症(新興感染症)は未知の病原体が原因であるため、体外診断薬はまだ存在しない。そこで、新興感染症に対しては、公開された病原体のゲノム配列情報に基づいて、国立感染症研究所(感染研)が、必要な試薬や装置を組み合わせ、自家調整(home-brew)の遺伝子検査(RT-PCR法)を確立。感染研が主導して、全国に約八十数カ所ある傘下の地方衛生研究所でも、感染拡大に備え、同様の自家調整の遺伝子検査ができるようにして、全国で検査体制を整える。
遺伝子検査(RT-PCR法)とは、鼻咽頭拭い液(鼻から綿棒を挿入し鼻中腔の近くでこすり取った検査材料)などに微量に含まれる病原体特有のゲノム配列だけをPCR法と呼ばれる手法で増幅し、病原体の有無を調べる検査だ。PCR法のための装置が必要で、迅速診断キットに比べると検査に時間がかかるなど、どこでも実施できるわけではない。ただ、病原体のゲノム配列情報があれば試薬(増幅に必要なプライマーや検出に必要なプローブ)を設計・製造できるので、新興感染症に対しては、まずはPCR法で対応するというわけだ。実際、「これまでの新興感染症に対しては、国内の感染例が限られていたこともあり、この方式で十分対応が可能だった」とある業界関係者は話す。
1月下旬、感染研が自家調整の遺伝子検査を確立
今回の新型コロナウイルスに関しては、中国当局が1月12日にウイルスのゲノム配列情報を公開。それを受けて国内では、感染研が1月下旬、自家調整の遺伝子検査の手法を確立した。具体的には、標的とするウイルスゲノムのオープンリーディングフレーム(ORF)1a領域とスパイク(S)蛋白質の遺伝子領域の2カ所をPCR法で増幅し、増幅産物の有無を検出する検査だ。検査の詳細については、感染研が「病原体検出マニュアル 2019-nCoV」を作成、随時更新されている(ただし、感度や特異度などは公表されていない)。そして、1月28日からマニュアルを配り、感染研の主導で、全国の地方衛生研究所で、同様の自家調整の遺伝子検査を実施できる体制を整え始めた。ちなみに、感染研が確立した自家調整の遺伝子検査には、大きく分けて2つの手法が示されている。1つは、「2ステップRT-PCR法と電気泳動」、もう1つは「TaqManプローブを用いたリアルタイム1ステップRT-PCR法」だ。
このうち、マニュアル前半に掲載されている「2ステップRT-PCR法と電気泳動」は、2回に分けてPCR法で標的の領域を増幅し、アガロースゲルによる電気泳動で増幅産物があるかどうかを確認するという手法だ。しかし、この手法について複数の専門家は、「まるで研究者の実験のよう。手間も時間もかかり、臨床検査ではほぼ使われていない」と指摘する。もう一方の「TaqManプローブを用いたリアルタイム1ステップRT-PCR法」を使えば、手間もかからず、3時間程度で検査ができるが、専門家は「2ステップRT-PCR法をマニュアルに掲載するに当たり、大規模な検査の必要性を認識していたとは思えない」「もし感染研が、前者の手法で遺伝子検査を行っていたとしたら、さらに時間がかかっていることになる」と指摘している。
2月上旬、検査拡充へ受託検査会社へ打診を開始
とはいえ、地方衛生研究所で体制が整うまでには、時間がかかる。感染研を中心とした検査体制では、新型コロナウイルスの遺伝子検査のキャパシティーは、2月12日時点で1日最大300件程度。通常、この手の検査を大規模に行っているわけではない感染研の人員には限りがあり、感染研が確立した自家調整の遺伝子検査に必要な試薬(主にプライマーとプローブ)も、この時点で大量に製造・流通しているわけではなかった。政府は、1月28日、新型コロナウイルスの感染症を、感染症法に基づく「指定感染症」と検疫法の「検疫感染症」に指定する政令を閣議決定。新型コロナウイルスの遺伝子検査は、公費負担で行う行政検査となった。しかし、その直後から、数百人に上る武漢からの帰国者や、数千人規模のクルーズ船の乗員乗客など、検疫の対象者が一気に増加。かつてないほどの規模で遺伝子検査を実施する必要に迫られ、これまでの感染研頼りの検査体制では追い付かなくなった。
政府や厚労省、感染研が、新型コロナウイルスの遺伝子検査の需要について、当初どのような見積もりを立てていたかは分からないが、ある業界関係者は、「厚労省は恐らく『これまで通り、感染研が中心となって自家調整の遺伝子検査を実施すれば乗り切れるだろう』と高をくくっていたのではないか」と批判する。
感染研がフル稼働しても、遺伝子検査のキャパシティーが絶対的に足りない──。深刻化する状況に、厚労省や感染研は2月上旬から、検査体制拡充に向けて受託検査会社へ遺伝子検査の実施の打診を始めた。ただし、感染研が確立したのは、自家調整の遺伝子検査。一般的に自家調整の検査というのは、承認された体外診断薬とは異なり、「事前に必要な試薬を集めて調整したり、検査の質を確認したりといった作業が必要になる」(専門家)。
打診を受けた受託検査会社のうち、エスアールエルは、こうした事態を見越して「感染研の自家調整の遺伝子検査を自社でも実施できるよう、試薬の調達も含めて準備していた」(広報担当者)。2020年2月12日、同社は業界では初めて、新型コロナウイルスの遺伝子検査を受託すると発表した。ただ、「そうでなかった企業にとっては、試薬の調整などからしなければならず、自家調整の遺伝子検査を受託する体制をすぐに整えるのは相当難しかったはずだ」と業界関係者は指摘する。
2月中旬、Roche社の研究用試薬と同等性を確認
そうした事情がどの程度影響したのかは分からないが、受託検査会社へ打診を始めた直後、2月13日に感染研は新型コロナウイルスの遺伝子検査にある研究用試薬を使えるように、前述したマニュアルを変更した。その研究用試薬とは、スイスRoche社が供給している、世界初の新型コロナウイルスの遺伝子検査(RT-PCR法)のための研究用試薬だ。実はRoche社は、ドイツTib-Molbiol社が開発した研究用試薬(プライマーとプローブ)の大規模製造・供給を、1月末からスタートさせている。その遺伝子検査とは、標的とするウイルスゲノムの核(N)蛋白質の遺伝子領域とエンベロープ(E)蛋白質の遺伝子領域の2カ所をPCR法で増幅し、増幅産物の有無を検出する検査であり、Tib-Molbiol社の研究用試薬とRoche社の装置を組み合わせることで検査が可能だ。
文字通り、研究用の試薬であり、体外診断薬の承認を取っているわけではないものの、「試薬が大量に製造・供給されている上、同社の実績からしても試薬の品質など安心して使えるといった利点がある。実際、中国などで新型コロナウイルスの遺伝子検査にも活用されている」(業界関係者)。Roche社の診断薬事業部門の日本法人であるロシュ・ダイアグノスティックスも、早々に国内で研究用試薬や装置を供給する体制を整えていたとみられるが、感染研が、自家調整の遺伝子検査と、Roche社の研究用試薬を使った遺伝子検査が「同等である」と確認し、マニュアルに載せたのは、2月13日になってからだった。

研究用試薬の導入がここまで遅れた理由について、複数の専門家は、「自家調整の遺伝子検査は臨床向けに開発されているので問題ないが、研究用試薬は研究向けなので、厚労省は使わせたくなかったというのが本音だろう」と口をそろえる。とはいえ、研究用試薬の導入に踏み切らなければ、受託検査会社が新型コロナウイルスの遺伝子検査を受けるのは難しかった可能性がある。というのも、エスアールエル以外で、遺伝子検査の受託を決めた受託検査会社の中には、「感染研が確立した自家調整の遺伝子検査をやろうにも、試薬の調達が難しかった」(ある受託検査会社)として、Roche社の研究用試薬を用いた遺伝子検査を行っていることが明らかになっているからだ。
ちなみに、厚労省は受託検査会社への打診後、2月18日前後から、文部科学省を通じ、全国の大学病院に遺伝子検査が可能かどうかのヒアリングを開始している。ただその際は、「感染研の自家調整の遺伝子検査に必要な試薬を配布するので、遺伝子検査ができるかどうかというヒアリングで、感染研の自家調整の遺伝子検査が前提になっていた」(ある大学病院の医師)という。ヒアリングに対して同医師は、「自家調整の遺伝子検査に使える装置が2台あり、1日当たり十数例の検査であれば可能だと回答」。その地域の地方衛生研究所で検査がキャパシティーを超えた場合、大学病院の検査室で検査を実施することになっているという。
研究用試薬の導入を決断し、検査体制はどこまで拡充できたのか──。政府によれば、受託検査会社や大学病院などで実施できるようになった結果、新型コロナウイルスの遺伝子検査のキャパシティーは、2月18日までに1日最大3800件に増加したという。しかし、実際に検査を実施した件数は、18日が996件、19日が672件、20日が656件、21日が1594件、22日が1166件、23日が675件、24日が590件、25日が863件──と大幅に下回っている。
2月下旬、医療機関から「検査ができない」との声
現状、新型コロナウイルスの遺伝子検査は、公費負担で行う行政検査となっており、検査対象基準(図1)は厚労省が定め、随時更新している。2月17日の基準では、濃厚接触歴などが無くとも、新型コロナウイルス以外の呼吸器感染症が否定されれば、検査対象になる。検査に当たっては、事前に保健所へ相談し、検査が決まれば医師が検体を採取。感染研や地方衛生研究所で検査を実施するか、前述の臨床検査会社や一部の大学病院の協力を得て、検査を実施する流れだ。
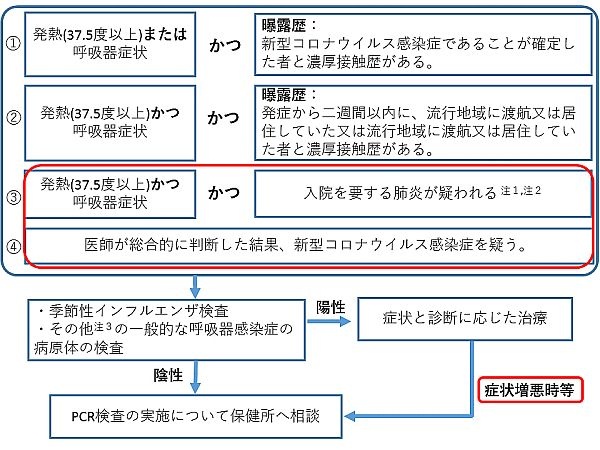
2月21日に政府は、非公開の全国800カ所の医療機関に帰国者・接触者専門外来を設置し、感染の疑い症例を診察し、検査につなげられる体制を整備している。ただ、そうした医療機関以外から感染者が出たことなどを受け、現在は、それ以外の医療機関からも保健所を介して、検査を依頼できる体制になっている。そして、一部の医療機関からは、「新型コロナウイルスを疑い、検査を依頼しようと思ったが、保健所に断られた」とか「そもそも保健所の電話がつながらない」といった声が出てきている状況だ(図2)。
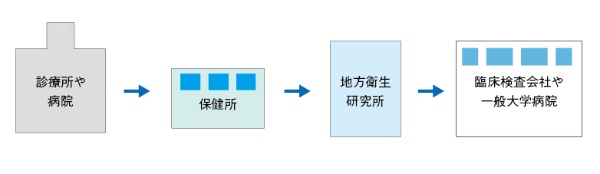
背景には、依頼元の医療機関が増える中、保健所が、検査の依頼への対応から、検査の優先順位付け、入院先の調整など、通常業務に加えて、様々な業務をこなさなければならないことがあるとみられる。また、検査を受ける地方衛生研究所の中には、検査の実施に加えて、医療機関まで検体の収集などに出向いているところもある。単純に、試薬と装置がそろっていれば検査ができるというわけではないのが実情だ。とはいえ、今後国内で感染拡大が広がる可能性を念頭に入れれば、「感染拡大の実情を把握するためにも、あらゆる病院や診療所で、医師の判断で検査ができる実施体制の構築が必要だ」と専門家は指摘する。
2月末、遺伝子検査の保険適用へ動きだした厚労省
加藤勝信厚生労働大臣は、2月27日、衆議院予算委員会において、遺伝子検査の体制拡充や保険適用に向けて検討を進めると表明した。厚労省が、感染研が確立した自家調整の遺伝子検査か、Roche社の研究用試薬を用いた遺伝子検査か、どの遺伝子検査も保険適用するのかは分かっていない。ただ、承認された体外診断薬が存在しない状況のまま、遺伝子検査が保険適用されることは間違いなさそうだ。
保険適用に当たっては、その遺伝子検査が分析的妥当性(測定対象がきちんと測定できているか、再現性、陽性率、陰性率など)、臨床的妥当性(検査結果の意味付けが十分か、感度、特異度など)、臨床的有用性(診断がつくことで治療に結び付くかなど臨床上のメリット)を満たしていることが確認され、厚労省の中央社会保険医療協議会総会で承認されることが必要だ。

もっとも、そこに至るまでには、そもそも医師が感染防御をした上で検体を採取できるか、民間の輸送業者などを活用して検体をスムーズに輸送できるか、受託検査会社などが受託した検査をこなせるか、必要な試薬や装置を確保できるかなど、確認や調整が必要となる課題も多い。また、新型コロナウイルスの感染症は、現状で指定感染症に指定されている。厚労省の幹部によれば、指定感染症のまま保険適用することもできるというが、指定から外すのかどうかなども含め、法的な整理も必要になる。
加えて、実際の保険適用に際しては、「保険償還の対象となる対象患者」や「遺伝子検査を実施できる施設の要件」も定められる見通しだ。保険適用への検討を進める理由について、厚労省の幹部が「患者数の増加に伴って、今後、新型コロナウイルスの診療が一般診療に移行していくことが考えられるため」と説明していることからも、保険適用されれば、現状よりも多くの疑い患者が検査を受けられると期待される。
検査の拡大に伴って生じる「検査の質」という新たな懸念
ただ、それに伴って遺伝子検査の実施施設が拡大すれば、新たな懸念も生じる。「遺伝子検査の質を担保できるか」という懸念だ。前述した通り、現状、新型コロナウイルスに対しては、体外診断薬が承認されていない。実施されているのは、事前に必要な試薬を集めて調整したり、検査の質を確認したりといった作業が必要になる、自家調整の遺伝子検査などが中心だ。現状では、受託検査会社や一部の大学病院に限られているが「もし多くの病院で実施されるようになれば、正しい検査の結果が出るかどうかに施設間差が生じるのでは」と専門家は指摘する。
06年度に保険適用された、進行性筋ジストロフィー遺伝子検査をはじめとして、未承認の試薬や装置を用いる遺伝子検査であっても、保険適用されているケースは他にもある。患者数が少なく、市場性が乏しいために、企業が開発を手掛けないためだ。ただ、そうした遺伝子検査については以前から、「正しい結果が出るように、検査の質を管理し、分析学的妥当性などを担保する取り組みが必要だ」といった指摘がされている。
新型コロナウイルスの遺伝子検査について、ある専門家は、「検体からRNAを抽出する工程など、施設間差が結果に影響するのではないか。RNAをうまく抽出できないと、結果は偽陰性になる」と指摘する。厚労省の幹部は「難病の遺伝子検査など、未承認の試薬でも保険適用されたものはある」と前例があることを強調するが、難病と比較にならないほど、多くの検査が実施されるとみられる上、偽陰性が出れば感染拡大につながるリスクが生じる。保険適用に当たり、どこまで遺伝子検査を実施できる施設を広げるかはまだ分からないが、検査の質の担保は避けては通れない課題と言えそうだ。
海外では、1月下旬以降、米国や中国、韓国などが、新型コロナウイルスの遺伝子検査の検査体制の増強を進めている。
米国では、感染研同様、公開された新型コロナウイルスのゲノム配列情報を基に、米疾病対策センター(CDC)が自家調整の遺伝子検査(リアルタイムRT-PCR法)を確立した。自家調整の遺伝子検査に必要な最低限の試薬(プライマーとプローブ、ポジティブコントロール)を診断パネルとしてキット化。2月4日付で、同診断パネルについて米食品医薬品局(FDA)から緊急使用許可(Emergency Use Authorization:EUA)を取得した。1セットの診断パネルで700例から800例の遺伝子検査が可能だという。

その上でCDCは、2月上旬から、臨床検査室改善(CLIA)法に基づく認定を受け、高度かつ複雑な臨床検査を行えると確認されている臨床検査会社や検査ラボに同診断パネルの提供を始めている。
というのも、FDAから緊急使用許可を取っているとはいえ、CDCの診断パネルは、あくまでも自家調整の遺伝子検査であるため、検査の質を担保するために一定以上の水準を満たした検査ラボにのみ提供しますというわけだ。ただ、一部報道によれば、一部の検査キットの性能に問題があると分かり、導入に遅れが出ているという。
また、中国や韓国では、Roche社などの研究用試薬を用いた遺伝子検査が実施されているもようだ。韓国では、正しく検査が実施できるか、検証を行った上で、順次、研究用試薬による遺伝子検査を行う体制を整えているという。
もっとも、日本では国民皆保険制度の下、誰でも治療を受けられる環境が整っているが、海外では加入している保険によって治療内容が限定されるところもある。
